现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.336 g。
(1)试通过计算确定M2CO3的M为何种元素。
(2)有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?
现有H2SO4和Na2SO4混合溶液200 mL,其中硫酸的物质的量浓度为1 mol·L-1,硫酸钠的物质的量浓度为0.5 mol·L-1。若要使硫酸和硫酸钠的物质的量浓度分别为2 mol·L-1和0.2 mol·L-1,应加入质量分数为55.8%的硫酸溶液(ρ="1.35" g·mL-1)多少毫升后再加蒸馏水配制?
在一定条件下,将物质的量之比为1∶3的N2和H2102g通入密闭容器中,达到平衡后,测知混合气体的平均相对分子质量为12.5。求混合气体中NH3的质量?
在密闭的容器中,将CO和水蒸气的混合气体加热到800℃时,有下列平衡:CO(g)+H2O(g)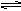 CO2(g)+H2(g),且平衡常数K=1,若用2mol CO和10mol H2O(g)相互混合并加热到800℃,则CO的转化率为多少?
CO2(g)+H2(g),且平衡常数K=1,若用2mol CO和10mol H2O(g)相互混合并加热到800℃,则CO的转化率为多少?
mg的饱和一元醇,在氧气中完全燃烧后,产生14.4g水和13.44L(标准状况下)二氧化碳气体.
(1)试确定该醇的化学式.
(2)m的值是多少?
标准状况下4.48L某烯烃和CO的混合气体与足量的氧气混合点燃,使之反应,将反应完毕后生成的气体通过浓硫酸,浓硫酸增重7.2g,并测得剩余气体中CO2为11.2L(标准状况),求此烯烃分子式.