下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(H+)+c(CH3COOH)
D.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
下列变化过程中,只破坏共价键的是
| A.I2升华 | B.NaCl颗粒高温熔化 |
| C.HCl溶于水得盐酸 | D.从NH4HCO3中闻到了刺激性气味 |
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
| A.第二种粒子是氧元素的另一种同位素 |
| B.“四中子”不显电性 |
| C.“四中子”的质量与一个4He原子质量近似相等 |
| D.第二种粒子的化学式为O4,与O2互为同素异形体 |
已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
| A.原子序数:Y>X>Z>W |
| B.离子半径:X>Y>Z>W |
| C.原子最外层电子数:Z>W>Y>X |
| D.还原性:X>Y,W2—>Z— |
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列顺序正确的是
甲:在500℃时,SO2和O2各10 mol反应
乙:在500℃时,用 V2O5做催化剂,10 mol SO2和5 mol O2反应
丙:在450℃时,8mol SO2和5 mol O2反应
丁:在500℃时,8mol SO2和5 mol O2反应
| A.甲、乙、丙、丁 | B.乙、甲、丙、丁 |
| C.乙、甲、丁、丙 | D.丁、丙、乙、甲 |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是
A.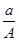 (A-N+m)mol (A-N+m)mol |
B.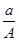 (A-N)mol (A-N)mol |
C.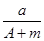 (A-N)mol (A-N)mol |
D.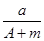 (A-N+m)mol (A-N+m)mol |