“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2 =2H2O,负极反 应为H2 + CO32—→CO2↑ + H2O+ 2e—,则下列推断中,正确的是
应为H2 + CO32—→CO2↑ + H2O+ 2e—,则下列推断中,正确的是
| A.电池工作时,CO32—向负极移动 |
| B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极 |
| C.正极的电极反应为:4OH—→O2↑+2H2O+2e— |
| D.通氧气的电极为阳极,发生氧化反应 |
下列物质加热熔化时破坏极性共价键的是
| A.干冰 | B.二氧化硅 | C.晶体硅 | D.氢氧化钠 |
下列物质的用途中,利用物质氧化性的是
| A.氧化铝做耐火材料 | B.K、Na合金作原子反应堆导热剂 |
| C.焦炭用于炼铁工业 | D.次氯酸消毒餐具 |
有关元素X、Y、Z、W的信息如下
| 元素 |
有关信息 |
| X |
所在主族序数与所在周期序数之差为4 |
| Y |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W |
地壳中含量最高的金属元素 |
请回答下列问题:
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为_______________。
(2)铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________ 。
(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(4)以上述所得WX3溶液为原料制取无水WX3,先制得WX3·6H2O晶体,主要操作包括__________________________,在_____________________条件下加热WX3·6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明)_______________________________。
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是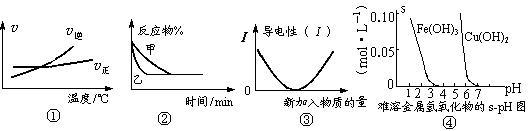
A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0 2AB3(g)”的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性。其分子结构如右图:下列说法正确的是
| A.该物质的分子式为C12H19N4O7 |
| B.在一定条件下,该物质可以发生消去、加成、取代等反应 |
| C.1mol该物质与NaOH溶液反应,可以消耗4mol NaOH |
| D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色应 |