化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2===2HCl推测:H2+Br2===2HBr。但类比是相对的,如根据2Na2O2+2CO2===2Na2CO3+O2,类推2Na2O2+2SO2===2Na2SO3+O2是错误的,应该是Na2O2+SO2===Na2SO4。下列各组类比中正确的是
| A.由溶解性CaCO3<Ca(HCO3)2,推测:Na2CO3<NaHCO3 |
| B.由CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,推测:SO2+Ca(ClO)2+H2O===CaSO3↓+2HClO |
| C.由2CO2+Ca(ClO)2+2H2O===Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O===NaHCO3+HClO |
| D.由Na2SO3+2HCl===2NaCl+H2O+SO2↑,推测:Na2SO3+2HNO3===2NaNO3+H2O+SO2↑ |
根据元素周期表的性质递变规律,第7周期若排满,将包含( )
①金属元素②过渡元素③非金属元素④稀有气体元素
| A.①② | B.②③ | C.①②③ | D.①②③④ |
下列氧化物按其形成的含氧酸酸性递增顺序排列的是()
| A.SiO2<CO2<SO3<P2O5 | B.SiO2<CO2<P2O5<SO3 |
| C.CO2<SiO2<P2O5<SO3 | D.CO2<P2O5<SO3<SiO2 |
下列物质属离子化合物的是()
| A.苛性钾 | B.碘化氢 | C.硫酸 | D.醋酸 |
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第7周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是( )
| A.类铅元素原子的最外层电子数为4 |
| B.其常见价态为+2、+3、+4 |
| C.它的金属性比铅强 |
| D.它的原子半径比铅小 |
A、B分别为第3周期和第4周期的同一主族不同元素的原子,它们原子核内质子数都等于中子数。①若A为ⅡA族,其质量数为x,则B的质子数为y。若A为ⅣA族,其质子数为m,则B的质量数为n。在下列各组值中,y和n的值分别是( )
A.(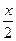 +18)和(2m+18) B.(
+18)和(2m+18) B.(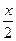 +8)和(2m+8)
+8)和(2m+8)
C.(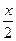 +8)和(2m+36)D.(
+8)和(2m+36)D.(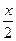 +18)和(2m+18)
+18)和(2m+18)