下列说法正确的是
| A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH)相同 |
| B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7 |
| C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7 |
| D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡 |
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为()
| A.9.6g | B.6.4 g | C.3.2 g | D.2.4 g |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4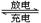 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
| A.放电时Mg2+向正极迁移 |
| B.放电时正极反应为Mo3S4+2xe-===Mo3S42x- |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为Mg2++2e-===Mg |
下列叙述不正确的是( )
| A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| B.向煤中加入生石灰可减少对大气的污染 |
| C.完全由非金属元素组成的化合物可以形成离子化合物 |
| D.由氮气为原料合成氨是氮的固定 |
25 ℃、101 kPa下,①2Na (s)+1/2 O2(g)="==" Na2O(s) ΔH 1 =-414 kJ/mol
②2Na (s)+O2(g)===Na2O2(s) ΔH2=-511 kJ/mol,下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ/mol |