某温度下,H2(g)+CO2(g) 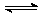 H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数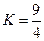 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是( )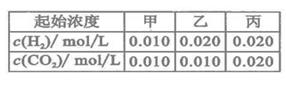
| A.平衡时,乙中CO2的转化率大于60% |
| B.平衡时,甲和丙中H2的转化率均是60% |
| C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
| D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
有关化学用语正确的是( )
| A.溴乙烷的分子式C2H5Br | B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式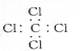 |
D.乙烯的最简式C2H4 |
1828年德国化学家维勒从无机物制得了有机物,打破了只能从有机物取得有机物的学说,这种有机物是( )
| A.纤维素 | B.树脂 | C.橡胶 | D.尿素 |
下列物质能跟镁反应并生成氢气的是
| A.氢氧化钠溶液 | B.甲酸溶液 |
| C.氯化铵溶液 | D.碳酸钠溶液 |
常温下,将稀氨水逐滴加入到稀盐酸中,当溶液的PH =7时,下列关系正确的是
=7时,下列关系正确的是
| A.c(NH4+)=c(Cl-) | B.c(NH4+)>c(Cl-) |
| C.c(NH4+)<c(Cl-) | D.c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
莽草酸可用于合成甲型流感药物——达菲。下列关于莽草酸的叙述正确的是
| A.能与三氯化铁溶液发生显色反应 |
| B.1mol莽草酸最多消耗4molNaOH |
| C.能使溴的四氯化碳溶液褪色 |
| D.1mol莽草酸最多消耗4molNa[ |