据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理。他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验。
第一步 清洗: 取10 mL 10% H2O2溶液清洗附有银的试管。反应剧烈,并产生大量的气体(经验证为氧气),试管内壁上的银全部被清除干净,最后得澄清透明液体a。用激光照射液体a能看到丁达尔效应。
第二步 探究反应原理: 取2支试管,分别取液体a约1 mL,稀释至3 mL得液体b。
学生甲:将1支盛有液体b的试管进行如下实验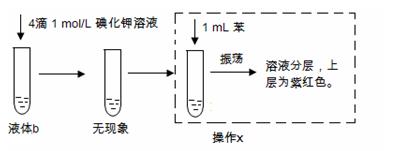
学生乙:向液体b中加入4~5滴稀硝酸酸化的2 mol/LNaCl溶液,溶液中出现白色沉淀。
通过上述实验,他们认为H2O2氧化了银单质。请回答:
(1)液体a在分散系分类中属于 。
(2)操作x名称是 。
(3)学生甲在液体b中加入碘化钾溶液,没有看到预期的黄色的碘化银沉淀,可能的原因是 (填序号)。
①液体a中的银元素大多数以银单质的形式存在
②过量的H2O2将I—氧化为I2
③加入的碘化钾溶液量太少
(4)学生乙在实验中加入4~5滴稀硝酸酸化的原因是 。
(5)如果银与H2O2反应生成的物质对H2O2的分解有催化作用,通过分析可以推测,起催化作用的物质是
实验室需要配制0.55mol·L-1 NaOH溶液220 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1) 选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、_____________、__________________ 。
(2) 计算。配制该溶液需取NaOH晶体________g。
(3) 称量。
① 天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
② 称量过程中NaOH晶体应放于天平的__________(填“左盘”或“右盘”)。
(4) 溶解、冷却,该步实验中需要使用玻璃棒,目的是______________________________。
(5) 转移、洗涤。在转移时应使用玻璃棒引流,应注意______
;需要洗涤烧杯2~3次是为了________________________________________________________________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有______________(填字母,下同);偏小的有_____________;
无影响的有_____________。
A 称量时用生锈的砝码 B 将NaOH放在纸上称量
C NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 D 往容量瓶转移时有少量液体溅出
E、未洗涤溶解NaOH的烧杯F、定容时仰视刻度线
G、容量瓶未干燥就用来配制溶液
(16分)FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/LFeBr2溶液
(1) 配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II. 探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为。
(2)装置A的烧瓶中可装试剂为。
(3)B装置的名称是; E装置的作用是。
(4)通入C装置的两根导管左边较长、右边较短,目的是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(a、b的代数式表示)。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?。
某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]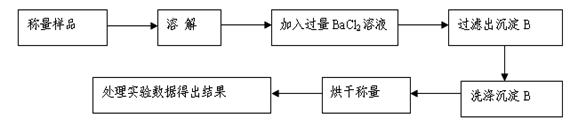
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为。
(2)洗涤沉淀B的操作是。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:
按如下左图所示装置进行实验:

(4)该实验中装置B盛放的物质是_____________________,分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入
N2的目的是______________________________。
(8分) 某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4后层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有;不含;
实验②:含有;不含;
实验③:含有;
(2)通过上述实验,不能确定是否存在的离子是。