金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— ="=" Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
100mL 6mol·L-1H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.Na2CO3(s) | B.水 | C.硝酸钾溶液 | D.盐酸 |
下列热化学方程式能表示可燃物的燃烧热的是
A. 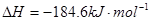 |
B.  |
C. |
D.  |
下列说法正确的是
| A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
| B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
0.01mol·L-1 NaOH溶液中的c(H+)是0.0005 mol·L-1 Ba(OH)2溶液中的c(H+)的
| A.10倍 | B.20倍 | C. 倍 倍 |
D.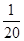 倍 倍 |
将浓度为0.1mol·L-1的CH3COOH溶液稀释10倍,下列粒子浓度减小最多的是
| A.CH3COO- | B.OH- | C.CH3COOH | D.H+ |