下列化学原理表述正确的是
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大; |
| B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3) |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多; |
下列说法中正确的是
A.三硝基甲苯的结构简式: |
| B.冰熔化时水分子中共价键发生断裂 |
| C.用溴水可以鉴别己烯、己烷、四氯化碳三种有机物 |
| D.在标准状况下,11.2L辛烷中的碳原子数为4 NA |
某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能是
| A.C2H6 | B.C4H10 | C.C5H12 | D.C8H18 |
有8种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、
⑦邻二甲苯、⑧环己烯,既能使酸性KMnO4溶液褪色,又能使溴水因反应褪色的是
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑤⑦⑧ |
某有机物的结构简式为: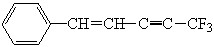 ,则下列说法中不正确的是
,则下列说法中不正确的是
| A.共平面的原子最多有19个 | B.共平面的原子至少有10个 |
| C.共平面的碳原子最多有11个 | D.共直线的碳原子最多有4个 |
下列图式表示的是石墨、氯化钠、干冰、金刚石四种晶体中微粒的排列方式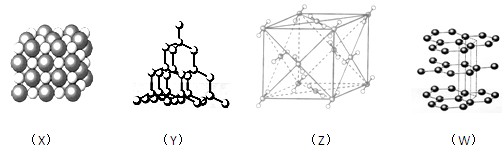
则这四种物质中对应熔点最低的排列方式是
| A.X | B.Y | C.Z | D.W |