下列说法正确的是
| A.由于H2O分子间存在氢键,所以H2O比H2S稳定。 |
| B.11.2 L O2和CO2的混合气体中含有6.02×1023个氧原子。 |
| C.固态NaCl不导电,是由于NaCl晶体中不存在阴、阳离子。 |
| D.可逆反应达平衡状态后,化学反应速率发生变化,平衡不一定移动。 |
甲乙两容器中发生相同的反应: A(g) + 3B(g) 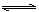 2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
A.体积:甲可能小于乙 B.C的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.A、C浓度比值c(A)/c(C):甲一定小于乙
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是()
| A.CH3OH(l)+3/2O2(g) |
| B.2CH3OH(l)+3O2(g) |
| C.2CH3OH(l)+3O2(g) |
| D.2CH3OH(l)+3O2(g) |
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是( )
2AB(g)达到平衡状态的标志是( )
| A.单位时间内生成n molA2,同时生成n molAB |
| B.容器内混合气体的平均相对分子质量不随时间变化 |
| C.单位时间内生成2n molAB,同时生成n molB2 |
| D.单位时间内一个A-A键断裂,同时生成二个A-B键 |
根据热化学方程式(在101 kPa时):S(s)+O2(g)===SO2(g)ΔH=-297.23 kJ/mol,分析下列说法中不正确的是 ( )
| A.S的燃烧热为297.23 kJ/mol |
| B.S(g)+O2(g)===SO2(g)放出的热量大于297.23 kJ |
| C.S(g)+O2(g)===SO2(g)放出的热量小于297.23 kJ |
| D.形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量 |
下列措施肯定能使化学反应速率增大的是( )
| A.增大反应物的量 | B.升高温度 | C.增大压强 | D.使用催化剂 |