下列实验操作,正确的是
| A.中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B.配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C.制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D.溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
在一密闭容器中,反应mA(g)+nB(g) pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A.化学计量数:m+n<p B.平衡向正反应方向移动
C.物质B的转化率减小 D.物质C的质量分数增加
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) ΔH<0。
C(g)+3D(g) ΔH<0。
该可逆反应的反应速率-时间、转化率-时间关系图如下: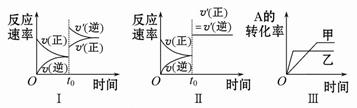
下列分析中不正确的是
| A.图Ⅰ可体现t0时升高温度对反应速率的影响 |
| B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)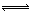 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
| A.该反应的化学平衡常数表达式是K= [ C ]4 [ D ]2 / [ A ]3 [ B ]2 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
下列反应中符合下图图像的是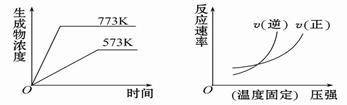
A.N2(g) + 3H2(g)  2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0) 2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0) |
B.2SO3(g)  2SO2(g) + O2(g) ΔH =" +" Q2 kJ·mol-1 (Q2>0) 2SO2(g) + O2(g) ΔH =" +" Q2 kJ·mol-1 (Q2>0) |
C.4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0) 4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0) |
D.H2(g) + CO(g)  C(s) + H2O(g) ΔH =" +" Q4 kJ·mol-1 (Q4>0) C(s) + H2O(g) ΔH =" +" Q4 kJ·mol-1 (Q4>0) |
已知下列反应的热化学方程式:
① C(金刚石,s) + O2(g) === CO2(g) ΔH1
② C(石墨,s) + O2(g) === CO2(g) ΔH2
③ C(石墨,s) === C(金刚石,s) ΔH3=1.9 kJ/mol
则下列说法正确的是
| A.石墨转化成金刚石的反应是吸热反应 |
| B.金刚石比石墨稳定 |
| C.ΔH3=ΔH1-ΔH2 |
| D.ΔH1>ΔH2 |