下列离子方程式正确的是( )
| A.NH4HCO3溶液中加入过量稀NaOH溶液:NH4++ OH-=NH3·H2O |
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水 Fe2++2H++H2O2=Fe3++2H2O |
| D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解): |
HSO3-+Br2+H2O=3H++2Br-+SO42-
下列排列顺序完全正确的组合是( )
①溶解性:Na2CO3>NaHCO3>AgCl>AgI
②氧化性:MnO2>Cl2>Fe3+>Cu2+
③常温下,α1、α2、α3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则α1=α2>α3
④同温下,1L0.5mol·L-1NH4Cl溶液中NH4+数与2L0.25mol·L-1NH4Cl溶液中NH4+数分别为a、b,则a>b
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |
工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡。有关该制备方法的叙述中,正确的是( )
(1)该方法应用了原电池工作原理 (2)该方法应用了电解池工作原理
(3)该方法不产生污染大气的二氧化硫 (4)该方法提高了硫酸的利用率
(5)该方法提高了铜的利用率
| A.(1)(3)(5) | B.(2)(3)(4) | C.(1)(3)(4) | D.(1)(3)(4)(5) |
某有机物的结构简式为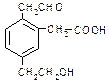 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )
①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原
| A.①③④⑤⑥⑦ | B.①③④⑤⑦ | C.①③⑤⑥⑦ | D.②③④⑤⑥ |
下列说法都正确的是( )
①江河入海口三角洲的形成通常与胶体的性质有关
②四川灾区重建使用了大量钢材,钢材是合金
③ “钡餐”中使用的硫酸钡是弱电解质
④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键
⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
| A.①②③④ | B.①②④⑥ | C.①②⑤⑥ | D.③④⑤⑥ |
下列实验中,“操作和现象”与“结论”对应关系正确的是()
| 操作和现象 |
结论 |
|
| A |
向纯碱粉末中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 |
酸性:盐酸>碳酸>苯酚 |
| B |
取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 |
该溶液中一定含有SO42— |
| C |
取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 |
该Fe(NO3)2试样已经变质 |
| D |
取皂化反应后的混合液滴入盛水的烧杯中,出现油滴 |
皂化反应不完全 |