可以证明可逆反应N2+3H2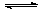 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体积压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L·min,逆反应速率v(NH3)=0.4mol/L·min
⑧υ正(N2)=υ逆(NH3)
⑨2υ正(H2)=3υ逆(NH3)
| A.全部 | B.只有①③④⑤⑨ |
| C.②③④⑤⑦⑨ | D.只有①③⑤⑥⑦ |
下列反应的离子方程式正确的是
| A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+ + 3H2O ="=" Fe(OH)3↓+ 3H+ |
| B.用小苏打治疗胃酸过多:HCO3- + H+ = CO2↑+ H2O |
| C.将氯气通入NaOH溶液中制取84消毒液:2Cl2 + 2OH- = ClO- + 3Cl- + H2O |
| D.向Na2O2固体中滴加水:Na2O2 + H2O = 2Na+ + 2OH- + O2↑ |
某溶液中含有Ba2+、HCO3-、Cl-、NO3-四种离子,先向溶液中加入足量NaOH溶液,再加入足量稀盐酸,溶液中大量减少的是
| A.Ba2+ | B.HCO3- | C.Cl- | D.NO3- |
下列关于电解质的叙述正确的是
| A.CaCO3在水中溶解度很小,所以CaCO3是弱电解质 |
| B.若某种电解质溶液中含有未电离的分子,则该电解质一定是弱电解质 |
| C.氯气和氨气的水溶液导电性都很好,所以它们是电解质 |
| D.SO3的水溶液可以导电,但它不是电解质 |
下列溶液中,溶质的物质的量浓度为1mol/L的是
| A.将40gNaOH溶于1L水所得的溶液 |
| B.将80g SO3溶于水配成1L的溶液 |
| C.将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水的溶液 |
| D.含K+为2mol的K2SO4溶液 |
精确配制一定物质的量浓度的NaOH溶液,下面实验操作中正确的是
| A.称量时,将NaOH固体直接放在天平托盘上面的纸上 |
| B.将称好的NaOH固体放入容量瓶中,加入少量水溶解 |
| C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中 |
| D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中 |