下图中a曲线表示一定条件下可逆反应X(g)+2Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是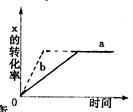
A 加入催化剂 B 增大Y的浓度
C 降低温度 D 增大体系压强
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,11.2 L乙醇中含有分子的数目为0.5NA |
| B.电解精炼铜的过程中转移了NA个电子,则阴极析出32 g铜 |
| C.2.8 g由氮气和一氧化碳组成的混合气体中含有原子的数目为0.1NA |
| D.加热条件下,20mL 10 mol/L 浓硝酸与足量铜反应转移电子数为0.1NA |
下列指定反应的离子方程式正确的是
| A.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
C.惰性电极电解MgCl2溶液:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| D.次氯酸钙溶液中通入少量的二氧化碳:2ClO-+CO2+H2O=CO32-+2HClO |
下列有关说法正确的是
| A.H2、SO2、CO2三种还原性气体都可用浓硫酸干燥 |
| B.二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 |
| C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+、无K+ |
| D.向Na2O2与水完全反应后的溶液咖MnO2,产生氧气,是由于该溶液中含有H2O2 |
短周期主族元素X、Y、Z、M、N的原子序数依次增大。X和M的原子核外均有两个未成对电子,但不处于同一主族,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应,N和M相邻。下列叙述正确的是
| A.原子最外层电子数由少到多的顺序:Y、Z、X、M、N |
| B.单质Y的熔点高于单质Z的熔点 |
| C.元素非金属性由弱到强的顺序:M、N、X |
| D.电解N和Y、Z形成的化合物可分别得到对应的Y和Z |
下列装置能达到实验目的的是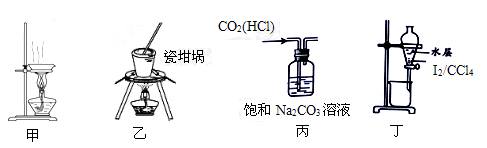
| A.用装置甲蒸发、结晶制取粗盐 | B.用装置乙加热熔融NaOH固体 |
| C.用装置丙除去CO2中的少量HCl | D.用装置丁进行萃取、分液 |