一定温度和压强下,下列各可逆反应达到化学平衡状态,各反应有如图所示的对应关系: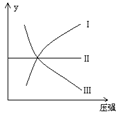
(1)N2(g)+3H2(g) 2NH3(g);ΔH<0(曲线Ⅰ)
2NH3(g);ΔH<0(曲线Ⅰ)
(2)H2(g)+I2(g) 2HI(g);ΔH>0(曲线Ⅱ)
2HI(g);ΔH>0(曲线Ⅱ)
(3)2SO3(g)  2SO2(g) +O2(g);ΔH>0(曲线Ⅲ)
2SO2(g) +O2(g);ΔH>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是
| A.平衡混合气中一种生成物的物质的量浓度 |
| B.平衡混合气中一种反应物的体积分数 |
| C.平衡混合气的平均相对分子质量 |
| D.平衡混合气中一种反应物的转化率 |
下列物质中,不能发生消去反应的是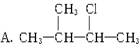 B.
B.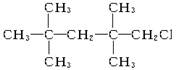
C.CH3CH2Br D.CH2ClCH2CH3
1—丁烯醇(CH2=CH—CH2—CH2OH)可发生的化学反应类型有:
①加成②氧化③酯化④加聚⑤取代
| A.①②③④⑤ | B.只有①②③ | C.只有①②③④ | D.只有①③④ |
下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO == CO2↑+H2O == CO2↑+H2O |
B.醋酸溶液与新制氢氧化铜反应:2H ++Cu(OH)2 ++Cu(OH)2  Cu2++2H2O Cu2++2H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 2C6H5OH+CO 2C6H5OH+CO |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+4[Ag(NH3)2]++4OH- CO
CO +2NH
+2NH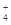 +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
下列关于反应中键的断裂位置的说法中正确的是
| A.乙醇和钠反应时,C—O键发生断裂 |
| B.乙醇在浓硫酸作用下生成乙烯时,O—H键发生断裂 |
| C.乙醛与氢气发生加成反应时,C—H键发生断裂 |
| D.乙醇与乙酸发生酯化反应时,乙醇中的O—H键和乙酸中的C—O键发生断裂 |
1,4-二氧六环是一种常见溶剂,它可以通过下列合成路线制得,则烃A应是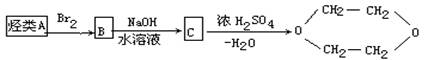
| A.1—丁烯 | B.1,3—丁二烯 | C.乙炔 | D.乙烯 |