(9分)(1)1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是____________。
| A.Na+(g)+Cl-(g)―→NaCl(s);△Q |
| B.Na(s)+Cl2(g)―→NaCl(s);△Q1 |
| C.Na(s)―→Na(g);△Q2 |
| D.Na(g)-e-―→Na+(g);△Q3 |
E.Cl2(g)―→Cl(g);△Q4
F.Cl(g)+e-―→Cl-(g);△Q5
②写出△Q1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式________________________________________________________________________
(2)可逆反应:aA(g)+bB(g)  cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
(14分)(1)与OH-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)250C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________
(3)汽车安全气囊中含MYn和红棕色金属氧化物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。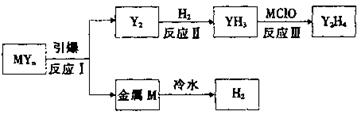
①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y2和3.5 mol H2发生反应II,测得平衡时的数据如表。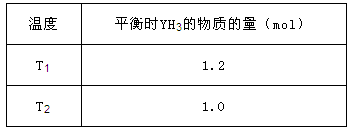
若该反应ΔH <0,则T1______T2(填“ >”、“ <”或“=”);在温度T2下,若经过10 min反应达到平衡,则平均速率v(YH3)=" ______,平衡常数为______" (保留两位有效数字)
③反应III的化学方程式为___________________。
【原创】X、Y、Z、E、F5种短周期元素,它们的原子序数依次增大,X的原子半径最小,Y和Z在同周期,Z的L层电子书是K层电子数的三倍,E是短周期元素中金属性最强的元素,F和Z同主族,它们的最外层电子数和为18。请回答下列问题:
(1)X、Y、Z、E、F的原子半径从大到小的顺序为___________________________(请填写元素符号)
(2)Z、F的非金属性强弱比较_______________________(填写元素符号)Y和F的最高价氧化物的水化物的酸性大小比较____________________(填写化学式)
(3)XYZE四种元素形成的化合物是______________(化学式)俗名为_________请写出该化合物与E的最高价氧化物的水化物反应的离子反应方程式____________________________________
(4)元素Y与元素Z以原子数比为1:2化合形成的化合物M,元素X和元素Z元素以原子数比为2:1化合形成的化合物Q, E与元素Z以原子个数比为1:1化合形成的化合物N,以M、Q都可以和N反应可以作为潜水艇和航空飞船的供氧剂,写出该反应的化学方程式______________________________、______________________________
A、B、C、D为原子序数依次增大的短周期元素。A原子核外电子有5种运动状态,B是地壳中含量最多的元素,A、C、D未成对电子数比为1:3:1。E有“生物金属”之称,E4+和氩原子的核外电子排布相同,请回答下列问题:(各元素用相应的元素符号表示)
(1)五种元素所形成的XY3型化合物的化学式可能为 ,其中心原子杂化方式依次为 。
(2)在元素周期表中与C同周期但不同区的金属元素有 种。
(3)B与D形成的以D为中心三原子分子中,B的质量分数约为47%,则分子的空间构型为 。
(4)E的一种氧化物M的晶胞结构如图所示,则M的化学式为 ,该晶体中氧原子的配位数为 。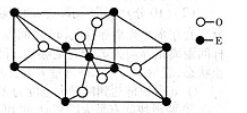
(5)下列晶体的堆积方式与E的单质晶体的堆积方式相同的有 。
①Po ②Zn ③Ag ④K
(6)B可形成两种同素异形体,其中在水中溶解度更大的是 (填化学式),原因是 。
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1
NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)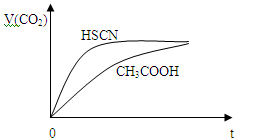
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+)
c.Kwd.醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。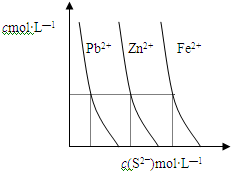
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图: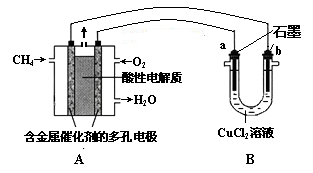
请回答:
①甲烷燃料电池的负极反应式是 。
②当线路中有0.1 mol电子通过时, 极增重________g
【原创】下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| 周期族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
Ⅷ |
| 1 |
A |
|||||||
| 2 |
B |
C |
L |
|||||
| 3 |
E |
F |
G |
D |
||||
| 4 |
H |
I |
(1)E和G形成的化合物的电子式______________,属于_____________化合物(“共价化合物”或者“离子化合物”)
(2)ABCEFGL中原子半径由大到小排列顺序___________________________(填写元素符号)
(3)ABCDEFGHIL中金属性最强_________非金属性最强__________化学性质最稳定的是________(填元素符号)
(4)F的单质与H的最高价氧化物的水化物反应的离子方程式________________________________
(5)ABEL形成的化合物________在生活中常被用来制作面包的发酵剂请写出相关化学反应方程式______________________________________________该化合物也能与E的最高价氧化物的水化物反应,请写出相关离子反应方程式______________________________________