离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示: ☆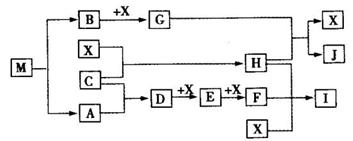
(1)实验室中物质I应如何保存? 。
(2)写出D与X反应的化学方程式 。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式 ; 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者 后者.(填大于、等于或小于)