高氯酸铵(NH4ClO4)加热至483 K时,可完全分解成N2、Cl2、O2和H2O,则反应中氧化产物与还原产物的物质的量之比是
| A.1∶1 | B.1∶3 | C.2∶1 | D.3∶1 |
如图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。该溶液的成分可能是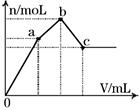
| A.NH4Al(SO4)2 | B.KAl(SO4)2 |
| C.Al2(SO4)3 | D.Na2SO4与NaAlO2组成的混合物 |
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是()
| A.反应后的固体混合物中Cu的质量为1 2.8 g |
| B.反应后的固体混合物中还含有碳 |
| C.反应后的固体混合物总质量为14.4 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol |
已知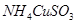 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 | B.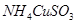 中硫元素被氧化 中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.1mol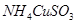 完全反应转移0.5mol电子 完全反应转移0.5mol电子 |
某溶液可能含有Clˉ、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
由此可知原溶液中
| A.至少存在5种离子 |
| B.Clˉ一定存在,且c(Clˉ)≥0.4mol/L |
| C.SO42ˉ、NH4+、一定存在,Clˉ可能不存在 |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
| A.X元素的氢化物的水溶液显碱性 |
| B.Z元素的离子半径大于W元素的离子半径 |
| C.Z元素的单质在一定条件下能与X元素的单质反应 |
| D.Y元素最高价氧化物的晶体具有很高的熔点和沸点 |