下列说法正确的是 ( )
| A.温度升高水的电离程度增大,pH值增大 |
| B.纯水中c(H+)与c(OH-)的乘积一定等于1×10-14 |
| C.某水溶液中只要c(H+)=c(OH-),则一定是中性的 |
| D.电离程度大的酸一定比电离程度小的酸pH值小 |
钢铁在腐蚀过程中,下列变化可能发生的是( )
①铁元素由+2价转化为+3价
②氧气被还原
③产生氢气
④Fe(OH)3失水生成Fe2O3·xH2O
⑤杂质碳被氧化而除去
| A.①② | B.③④ | C.①②③④ | D.①②③④⑤ |
相同材质的铁在图中的四种情况下最不易被腐蚀的是( )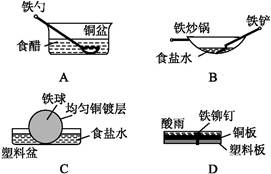
埋在地下的铸铁输油管道,在下列各种情况下,腐蚀最慢的是( )
| A.在含铁元素较多的酸性土壤中 |
| B.在潮湿疏松透气的土壤中 |
| C.在干燥致密不透气的土壤中 |
| D.在含碳粒较多的潮湿透气的中性土壤中 |
下列事实中,不能用电化学理论解释的是( )
| A.轮船水线以下的船壳上安装一定数量的锌块 |
| B.高温车间中钢铁设备的腐蚀 |
| C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后,反应速率提高 |
| D.镀锌铁比镀锡铁耐用 |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为:2Cu+H2O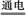 Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( )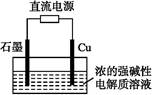
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极接直流电源的负极 |
| D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成 |