如下图所示:等温时,a、b容器开始体积相等,各充入等量的SO3(g),则平衡时SO3的转化率大小关系是 ( ) 
| A.a>b | B.a<b | C.a=b | D.无法确定 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,脱氧的同时可降低温度,延长糕点保质期 |
| B.脱氧过程中铁做原电池正极,电极反应为:Fe—2e— = Fe2+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O + O2 + 4e— = 4OH— |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
下列设备工作时,将化学能转化为热能的是
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是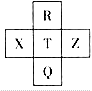
| A.非金属性:Z>T>X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.R、T、Q的最高正价相同 |
下列有关元素的性质及其递变规律正确的是
| A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1 |
| C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D.同周期主族金属元素的化合价越高,其原子失电子能力越强 |
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
| A.230Th的中子数比核外电子数多140 |
| B.230Th和232Th的化学性质相同 |
| C.232Th 转换成233U是化学变化 |
| D.Th 元素的相对原子质量是231 |