等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的胆矾晶体,下列图表示产生H2的体积V(升)与时间t的关系,其中正确的是( )。
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.含有NA个氮原子的氮气在标准状况下的体积约为11.2L |
| B.25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA |
| C.在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D.1 mo1 Na2O2与足量H2O反应,转移了2 NA个电子 |
“化学是一门中心学科,与社会、生活、科研密切的关系”。下列叙述中,不正确的是
| A.大量使用燃煤发电是形成雾霾的主要原因 |
| B.天然气、煤气大量泄漏遇到明火会爆炸 |
| C.利用化学反应可实现12C到14C的转化 |
| D.晶体硅可用于光伏发电、制造芯片 |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) △H<0,B、C的物质的量随时间变化的关系如图l,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
xC(g) △H<0,B、C的物质的量随时间变化的关系如图l,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是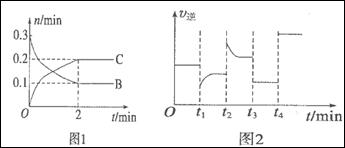
A.x=2,反应开始2 min内VB=0.1mol·L-1·min-1
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数减小
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c (B)不变
下列热化学方程式中,正确的是
| A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g),△H=-890.3 kJ·mol-1 |
B.500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g),△H = -38.6 kJ·mol-1 2NH3(g),△H = -38.6 kJ·mol-1 |
| C.HCl 和NaOH 反应的中和热△H =" -57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H = 2×(-57.3)kJ·mol -1 |
| D.在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1),△H = -571.6 kJ·mol-1 |
已知下列热化学方程式:
Zn(s)+ O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol
O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol
Hg(l)+ O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg( l) ΔH3,其中ΔH3是
| A.-441.8 kJ/mol | B.-254.6 kJ/mol |
| C.-260.4 kJ/mol | D.-438.9 kJ/mol |