某温度下,重水(D2O)的离子积常数为1.6×10-15 若用定义pH一样来规定
pD=-lg(D+),则在该温度下,下列叙述正确的是( )。
A 纯净的重水中,pD="7 "
B 1 L溶解有0.01 mol DC1的重水溶液,其pD=2
C 1 L溶解有0.01 mol NaOD的重水溶液,其pD=12
D 纯净的重水中, C(D+)C(OD-)>1.0×10-1 4
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.元素的单质氧化性:Z> Y > X | B.最高正化合价:Z > Y |
| C.原子半径:Z < Y < X | D.气态氢化物的稳定性:Z < Y < X |
下列化学用语正确的是
| A.钙离子的化学式: Ca2+ | B.中子数为20的氯原子: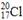 |
C.S2-的结构示意图: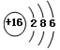 |
D.HCl的电子式: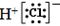 |
在右图所示的原电池中,下列说法不正确的是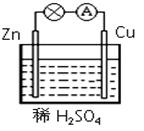
| A.溶液中的H+向Cu电极移动 |
| B.正极发生还原反应 |
| C.电子由锌片经电解质溶液流向铜片 |
D.负极反应为 Zn - 2e- Zn2+ Zn2+ |
在某一化学反应A + 2B 3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为
3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为
| A.0.05mol/(L·s) | B.0.05mol/L |
| C.0. 033 mol/(L·s) | D.0. 075 mol/(L·s) |
下列反应既是氧化还原反应,又是反应物总能量低于生成物总能量的是
| A.铝与稀盐酸的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与二氧化碳的反应 | D.甲烷在氧气中的燃烧反应 |