二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)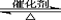 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: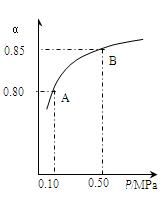
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____ 。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示)。放出的热量为______ kJ。
(3)新型纳米材料氧缺位铁酸盐
(MFe2Ox 3<x<4,M为Mn、Co、Zn或Ni),是由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
已知A、B、C、D、E 和F这6种分子所含原子数目依次为1、2、3、4、6、6,且都含有18个电子。又知B、C、 D和F是由两种元素的原子组成。请回答:
(1)B和C的分子式分别是和;C分子的立体结构呈形,该分子属于分子(填“极性”或“非极性”);
(2)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是,结合该物质的性质,推测D分子的极性(填“极性”或“非极性”);
(3)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是。
(4)我国神州8号使用的燃料就有F,F完全燃烧,生成一种空气中主要气体和另外一种常见液体。试写出F在纯氧中燃烧的化学方程式。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;其氢化物的水溶液显性。
(2)B元素的负二价离子和C元素的正二价离子的电子层结构都与氩相同,B的最高价氧化物的化学式为,C的元素 符号为;
符号为;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的电子排布式为。
看表填空。
 族元 族元素 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 1 |
(1) |
(2) |
||||||
| 2 |
(3) |
(4) |
(5) |
(6) |
||||
| 3 |
(7) |
(8) |
(9) |
(10) |
(A) (1)、(5)、(9)号元素,相互化合时可形成两种常见_______化合物,但溶于水后都可以电离出相同的_______离子。
(B)(8)、(10)号元素化合时,可通过_______键形成_______化合物。
(C)(1)、(5)、(7)号元素相互 化合形成的物质中,既有_______键,又有_______键,
化合形成的物质中,既有_______键,又有_______键,
用价层电子对互斥模型推测下列分子或离子的空间构型。
BeCl2;S Cl2;SO32-
Cl2;SO32-
某元素原子序数为24,试问:
它有个能层?个能级?占有个原子轨道?