下列离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| B.次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+ 2HClO |
| C.向100mL1mol/L的FeBr2溶液中通入 0.15mol Cl2: 2Fe2++4Br-+3Cl2= 2Fe3++2Br2+6Cl- |
| D.向明矾溶液逐滴加入Ba(OH)2溶液至Al3+离子刚好沉淀完全 |
Al3++SO42-+Ba2++3OH-=BaSO4↓ +Al(OH)3↓
有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
A.前20 min的平均反应速率v(C)=0.1 mol/(L·min)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| ① |
② |
③ |
④ |
|
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液显酸性
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
已知水在25℃和95℃时,其电离平衡曲线如右图所示,下列说法错误的是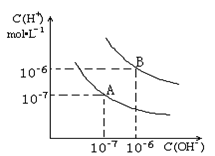
| A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L |
| B.15℃时,pH=7的溶液呈酸性 |
| C.AB连线上的点均表示中性溶液 |
| D.B点对应的温度高于A点对应的温度 |
上图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述错误的是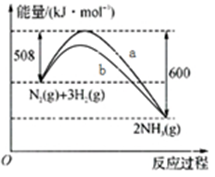
A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g) ΔH =-92kJ·mol-1 2NH3(g) ΔH =-92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的活化能和反应热都改变 |
| D.在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
上图为某化学反应的速率与时间的关系示意图。在t1 时刻改变温度或压强,正逆反应速率的变化都符合示意图的反应是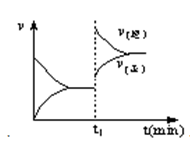
A.2SO2(g)+O2(g)  2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |