下列离子方程式书写不正确的是
| A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时, 2Al3+ + 7OH- = Al(OH)3↓+ AlO2- + 2H2O |
| B.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时, 2Fe2+ + 4Br- +3Cl2 =" 2" Fe3+ + 2Br2 + 6Cl- |
| C.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时 Cu2++2HS-= CuS↓+2H2S↑ |
| D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时, |
3 Fe +2NO3- +8H+ =" 3" Fe2+ +2NO↑+4H2O
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是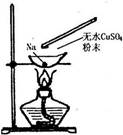
| A.上述反应是置换反应 |
| B.上述反应是放热反应 |
| C.上述反应中CuSO4表现了还原性 |
| D.加热且无水条件下,Na可以与CuSO4反应并生成Cu |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
草酸溶液能使酸性KMnO4溶液褪色,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++__(未配平)。关于此反应的叙述正确的是
| A.该反应的还原产物是CO2 | B.该反应右框内的产物是OH- |
| C.配平该反应后,H+计量数是6 | D.1molMnO4-在反应中失去5mol电子 |
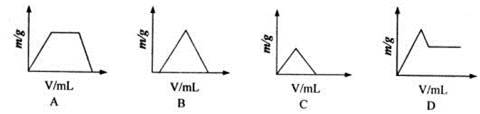
将过量CO2通入NaOH和Ca(OH)2的混合稀溶液中,生成沉淀的质量(m)和通入CO2(V)关系图,正确的是