下列有关试验操作的叙述正确的是

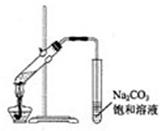
A.实验室常用上图所示的装置制取少量的乙酸乙酯 |
B.用50mL酸式滴定管可准确量取25.00mL 溶液 溶液 |
C.用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸 |
D.在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
下列说法正确的是
| A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- |
| B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- |
| C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ |
| D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
关于SO2的说法有:
①SO2是一种大气污染物;
②SO2和Cl2都有漂白作用,且这两种物质的漂白原理相同;
③工业上可用潮湿的石灰石粉末吸收SO2;
④SO2溶于水得硫酸,SO2是一种酸性氧化物;
⑤SO2是硫及某些含硫化合物在空气中燃烧的产物;
⑥SO2可以使酸性高锰酸钾溶液褪色,因为SO2具有漂白作用。其中正确的是
| A.①②⑤ | B.①③④⑤ | C.①③⑤ | D.①③⑤⑥ |
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂
是
| A.Fe(NO3)3溶液 | B.FeCl2溶液 | C.BaCl2溶液 | D.FeCl3溶液 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
下列离子方程式正确的是
| A.铜和稀硝酸的反应:Cu2++4H++2NO3-=Cu2++2NO2↑+2H2O |
| B.氯化铁腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+ |
| C.氯化铝溶液加入氨水:Al3++3OH-= Al(OH)3↓ |
D.实验室制氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |