某地有甲.乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+.Ba2+.Fe3+.Na+.Cl-.CO32-.NO3-.OH-。若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清只含硝酸钠而排放,污染程度会大大降低。关于污染源的分析,你认为正确的是
| A.CO32-和NO3-可能来自同一工厂 | B.Na+和NO3-来自同一工厂 |
| C.Ag+和Na+可能来自同一工厂 | D.Cl-和NO3-一定不在同一工厂 |
已知外电路中,电子由铜流向a极。有关下图中装置分析合理的一项是
| A.一段时间后锌片质量减少 |
| B.该装之中Cu极为正极 |
| C.b极的电极反应式:H2—2e—=2H+ |
| D.当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出。符合这一情况的是附表中的
| a极板 |
b极板 |
X电极 |
Z溶液 |
|
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸入b盐溶液中,无明显变化;将铜浸入c的盐溶液中,有金属c析出。据此可推知它们的活动性顺序由强到弱为
| A.dcab | B.dbac | C.dabc | D.badc |
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O=O:498则反应 P4(白磷)+3O2= P4O6的反应热ΔH为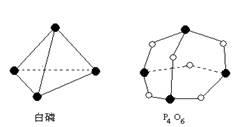
| A.-1638 kJ·mol-1 | B.+1638 kJ·mol-1 |
| C.-126 kJ·mol-1 | D.+126 kJ·mol-1 |
下列有关能量转换的说法不正确的是
| A.核能和地热能来自地球自身 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转化成化学能 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转化成化学能的过程 |