科学家已获得了极具理论研究意义的N4分子,其结构为正四面体,与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1mol氮氮叁键吸收941kJ热量,则
| A.N4的熔点比P4高 | B.1molN4气体转化为N2时要吸收748kJ能量 |
| C.N4是N2的同系物 | D.1molN4气体转化为N2时要放出724kJ能量 |
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。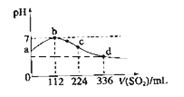
下列分析正确的是
| A.原H2S溶液的物质的量浓度为0.05 mol/L |
| B.氢硫酸的酸性比亚硫酸的酸性强 |
| C.b点水的电离程度比c点水的电离程度大 |
| D.a点对应溶液的导电性比d点强 |
已知常温下CH3COOH和NH3·H2O的电离常数相等,向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
| A.水的电离程度始终增大 |
B. 先增大再减小 先增大再减小 |
| C.c(CH3COOH)与c(CH3COO-)之和始终保持不变 |
| D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
根据碘与氢气反应的热化学方程式
①I2(g)+H2(g) 2HI(g) ΔH 1=" -9.48" kJ/mol
2HI(g) ΔH 1=" -9.48" kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH 2=" +26.48" kJ/mol,
2HI(g) ΔH 2=" +26.48" kJ/mol,
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应①的产物比反应②的产物稳定 |
| D.反应②的反应物总能量比反应①的反应物总能量低 |
一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol/L |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D.pH相同的①CH3COONa、②NaHCO3两种溶液的c(Na+):①>② |
有关下列图象的说法正确的是
| A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 |
| B.图乙表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应物的焓 |
| D.图丁中开关K置于a或b处均可减缓铁的腐蚀 |