下列物质的沸点由高到低排列的顺序是 ( )
①CH3(CH2)2CH3 ②(CH3)2CH(CH2)3CH3 ③(CH3)3CH
④CH3(CH2)3CH2OH ⑤(CH3CH2 CH2)2CHCl
| A.⑤②④①③ | B.④②⑤①③ | C.⑤④②①③ | D.②④⑤③① |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入22.4 L SO2参加反应时,有2NA个电子发生转移 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62—+6M。下列关于该反应的说法中,错误的是( )
| A.M为H2O |
| B.每还原1 mol氧化剂,就有3 mol电子转移 |
| C.还原性:SnCl2>As |
| D.氧化产物和还原产物的物质的量之比为2∶3 |
已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
| A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.四种铈的核素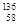 Ce、 Ce、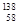 Ce、 Ce、 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S。赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2。下列说法正确的是( )
| A.该反应的氧化剂只有Cu2O |
| B.Cu2S在反应中既是氧化剂,又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.每生成19.2 g Cu,反应中转移1.8 mol电子 |
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为( )
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |