关于氢键,下列说法正确的是
| A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键 |
| B.氯化钠易溶于水是因为形成了氢键 |
| C.氨易液化与氨分子间存在氢键无关 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
下图所示,用石墨作电极进行电解,电解槽甲中盛AgNO3溶液,电解槽乙中盛有含二价金属G的氯化物溶液1 L,其物质的量浓度为0.1 mol·L-1,当通电一段时间后,电解槽甲中阴极增重0.27 g,乙中阴极增重0.14 g,则元素G的相对原子质量为( )
| A.112 | B.73 | C.64 | D.65 |
200 mL 2 mol·L-1的NaCl溶液(ρ="1.10" g·mL-1)在铜电极的电解池中不断搅拌下进行电解。当在阴极上有22.4 L的气体放出时停止电解。电解后溶液中NaCl的质量分数为( )
| A.12.72% | B.7.96% | C.8.30% | D.无法计算 |
若在铁片上镀锌,以下叙述错误的是( )
| A.把铁片与电源的正极相连 |
| B.电解质必须用含有锌离子的可溶性盐 |
| C.锌极发生氧化反应 |
D.铁极的电极反应式为Zn2++2e- Zn Zn |
用石墨作电极电解AlCl3溶液时,下图所示电解质溶液变化的曲线合理的是(不考虑Cl2溶解)( )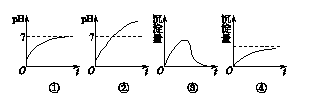
| A.①③ | B.①④ | C.②③ | D.②④ |
用Pt电极电解含有Cu2+和X3+均为0.1 mol的溶液,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是( )
| A.Cu2+>X3+>H+ | B.H+>X3+>Cu2+ |
| C.X3+>H+>Cu2+ | D.Cu2+>H+>X3+ |