反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是
| A.v(正)>v(逆) | B.v(正)<v(逆) |
| C.v(正)=v(逆) | D.无法判断 |
NA表示阿伏加德罗常数,下列说法正确的是
| A.常温常压下,11.2 L氯气所含原子数目为NA |
B.2 L 0.2 mol / L K2SO4溶液 物质的量浓度为0.4 mol / L 物质的量浓度为0.4 mol / L |
| C.1 mol Na作还原剂可提供电子数为2NA |
| D.同温、同压下NA个CO2分子和NA个O2分子的体积相同 |
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是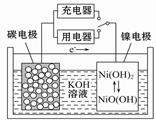
| A.充电时,阴极的电极反应为:Ni(OH)2+OH--e-===NiO(OH)+H2O |
| B.放电时,负极的电极反应为:H2-2e-+2OH-===2H2O |
| C.放电时,OH-移向镍电极 |
| D.充电时,将电池的碳电极与外电源的正极相连 |
某烃的分子式为C8H10,它滴入溴水中不能使溴水褪色,但它滴入酸性高锰酸钾溶液却能使其褪色。该有机物苯环上的一氯代物有3种,则该烃是
A. |
B. |
C. |
D. |
CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:
下列说法正确的是
| A.苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 |
| B.1 mol CPAE最多可与含3 mol NaOH的溶液发生反应 |
| C.用FeCl3溶液可以检测上述反应中是否有CPAE生成 |
| D.咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示。下列叙述中正确的是
| A.分子内消去一个水分子,产物有3种同分异构体 |
| B.该物质可以视为酚类 |
| C.能使溴的四氯化碳溶液褪色 |
| D.该物质分子中的所有碳原子均共面 |