一定条件下,存在可逆反应X(g)+2Y(g) 3Z(g),若X、Y、Z起始浓度分别为
3Z(g),若X、Y、Z起始浓度分别为 (均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是
(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是
A.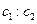 =l:2 =l:2 |
| B.达平衡状态时,生成Z的速率是生成X速率的3倍 |
| C.X、Y的转化率不相等 |
D.C2的取值范围为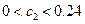 |
对于反应2SO2(g)+O2 (g) 2SO3(g)(放热反应),下列判断正确的是
2SO3(g)(放热反应),下列判断正确的是
| A.2体积SO2和足量O2反应,生成2体积SO3 |
| B.其他条件不变,降低温度,正反应速率增大,逆反应速率减小 |
| C.给定条件下该反应进行的限度为SO2消耗速率等于O2生成速率的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
已知反应A2+B2=2AB,破坏1molA2中的化学键消耗的能量为Q1 kJ,破坏1molB2中的化学键消耗的能量为Q2 kJ,形成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是
| A.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2<Q3 |
| D.若该反应为吸热反应,则Q1+Q2<Q3 |
可逆反应:2NO2(g)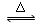 2NO(g)+O2(g)在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气 体的压强不再改变的状态
体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B. ①③⑤⑦ ①③⑤⑦ |
C.①③④⑤ | D.全部 |
在不同条件下分别测得2SO2(g)+O2 (g) 2SO3(g)的化学反应速率,其中表示该反应进行最快的是
2SO3(g)的化学反应速率,其中表示该反应进行最快的是
| A.v(SO2)="4" mol /(L·min) | B.v(O2)="3" mol /(L·min) |
| C.v(SO2)="0.1mol" /(L·s) | D.v(O2)="0.1" mol /(L·s) |
下列用水就能鉴别的一组物质是
| A.苯、正己烷、四氯化碳 | B.溴苯、乙醇、四氯化碳 |
| C.苯、乙醇、溴苯 | D.硝基苯、乙醇、乙酸 |