用水热法制备Fe3O4纳米颗粒的总反应如下:
3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是( )
| A.在反应中1molO2氧化了3mol Fe2+ |
| B.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| C.每生成1mol Fe3O4,转移3mol电子 |
| D.当转移1mol电子时,消耗56gS2O32- |
在一定条件下发生反应3A(g)+2B(g) zC(g)+2D(g),在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)="0.2" mol·L–1 ·min–1。则下列说法不正确的是
zC(g)+2D(g),在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)="0.2" mol·L–1 ·min–1。则下列说法不正确的是
A.z=4B.B的转化率是40%
C.A的平衡浓度是1.4 mol·L–1D.平衡时气体压强是原来的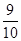
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有NH4+ |
| B |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在SO32- |
| C |
将Cl2通入品红溶液中,品红溶液褪色 |
证明Cl2的还原性 |
| D |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z+与Y2-具有相同的电子层结构,W与Y同主族。下列说法正确的是
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Z在周期表中的位置为第3周期、IB族 |
| C.X的最高价氧化物对应水化物的酸性比W的弱 |
| D.W比Y更容易与氢气反应 |
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X |
Y |
Z |
|
| ① |
NaOH溶液 |
Al |
稀硫酸 |
| ② |
KOH溶液 |
Br2 |
Na2SO3溶液 |
| ③ |
O2 |
N2 |
H2 |
| ④ |
FeCl3溶液 |
Cu |
浓硝酸 |
A.只有①③④ B.只有①②④
C.只有①②③ D.①②③④皆可
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.7.8 g Na2O2含有的阴离子数目为0.2 NA |
| B.PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,胶体粒子的数目小于NA |
| D.1.8 g重水(D2O)中含NA个质子和NA个中子 |