下列离子方程式正确的是
A.用两个铜电极电解稀盐酸:2H+ + 2Cl-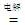 H2↑ + Cl2↑ H2↑ + Cl2↑ |
| B.将少量Ca(HCO3)2溶液中滴加过量的NaOH溶液中:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀AlO2- +HCO3- +H2O = Al(OH)3↓ + CO32- |
| D.向Na2FeO4溶液中加入稀硫酸产生Fe2(SO4)3: 4FeO42-+20 H+=4Fe3++3O2↑+10H2O |
水可以造福人类,但水被污染后却会给人类造成灾难。为了防止水被污染,下面①~⑤项措施中,可以采用的是( )
①抑制水中所有动植物的生长
②生活污水经过净化处理后再排放
③禁止使用农药和化肥
④不任意排放工业废水
⑤减少空气中硫氧化物和氮氧化物的含量,防止形成酸雨
| A.①②④ | B.③④⑤ |
| C.②④⑤ | D.②③④ |
下列材料中能使海水淡化的高分子材料是( )
| A.生物高分子材料 | B.高分子分离膜 |
| C.液晶高分子材料 | D.复合材料 |
海水淡化可采用膜分离技术,如图所示,对渗透膜右侧的海水加压,水分子可以通过渗透膜进入左侧淡化池,而海水中的各种离子不能通过渗透膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )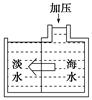
| A.溶质的质量增加 |
| B.溶剂的质量减少 |
| C.溶液的质量不变 |
| D.以上三种情况都有可能 |
下列变化属于化学变化的是( )
| A.蒸馏 | B.萃取 |
| C.反渗透 | D.电渗析 |
目前下列工艺过程没有直接使用离子交换技术的是( )
| A.硬水的软化 |
| B.电解饱和食盐水制备NaOH |
| C.电渗析淡化海水 |
| D.粗盐的提纯 |