在化学世界中,呆板的的阿拉伯数字变得鲜活起来,请把下列化学符号中数字“2”所表示的意义,将其序号填在相应的横线上:
(1)Fe2+ (2)NO2 (3)2NO (4)  O
O
(1) ,(2) ;
(3) ,(4) 。
写出反应的文字表达式并注明基本反应类型
(1)铁丝在氧气中燃烧________________________________________ ;()
(2)加热氯酸钾和二氧化锰的混合物制氧气___________________________________ ;()
如图是甲同学设计的一氧化碳与氧化铁的反应实验装置。回答下列问题:
(1)实验时应先点燃________(填“A”或“B”)处的酒精灯。
(2)反应中硬质玻璃管内的现象为;发生反应的方程式为。
(3)酒精灯B的作用是。
(4)乙同学认为甲设计的装置中尾气处理还可以用其他方法,请你为乙同学设计一种合理的尾气处理方法:________________________________________。
(5)丙同学质疑CO能否使石灰水变浑浊,因此其设计在CO通入Fe2O3之前应先通过澄清石灰水以排除CO与澄清石灰水反应,试对此做出评价,你认为丙的设计________(填“必要”或“不必要”),理由是___________________________。
(6)丁同学为检验反应有铁生成进行如下实验:将反应后的固体取少量放入稀盐酸中观察到有气泡冒出。请写出该反应的方程式:。
实验室常用下列装置来制取气体: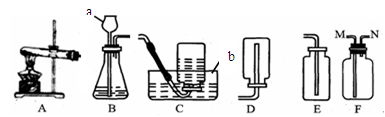
(1)写出图中有标号仪器的名称:a___________、b_____________。
(2)用氯酸钾和二氧化锰来制取氧气时,可选用的发生装置为(填写装置编号)发生反应的化学方程式为__________________________________________。
(3)用E装置收集二氧化碳的依据是_________,可用检验该气体是否为二氧化碳。若用F装置来收集CO2,气体应从_________导管口进入。(选填“M”或“N”)
(4)下图是实验室用双氧水制取少量氧气的主要步骤,这些步骤的正确顺序是(填字母标号,下同)_________,其中操作有误的是_________。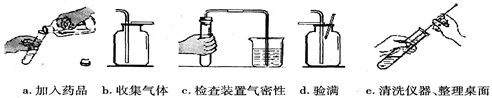
某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成100g 10%的稀H2SO4:
(1)填写下列操作步骤:
①所需浓H2SO4的体积为。
②如果实验室有a、10mLb、20mLc、50mLd、100mL量筒,应选用(填字母序号)量筒量取。读数时,使液体的正好跟刻度相平。;
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里。
④用不断搅拌。
(2)请指出上述操作中一处明显错误:。(填写操作步骤中的序号)
(3)误差分析:(填偏高、偏低、无影响)操作②中量取时发现量筒不干净,用水洗净后直接量取,所配溶液的溶质质量分数将。
(4)小王想粗略测定所配溶液的酸碱度可选用,请你告诉他如何操作。
“长征三号乙”火箭将嫦娥三号平稳送到月球,是中国目前运载能力最大的运载火箭,也是发射高轨道卫星的主力火箭。长征三号乙火箭除原型号外,还有一增强型号,其运载能力有所加强。其中第一、二节燃料:四氧化二氮+联氨,第三节燃料:液态氧+液态氢
(1)请你在□内填入适当数字帮助完成第一、二节燃料反应的方程式:
□N2H4+N2O4=□N2↑+4H2O↑
(2)请写出第三节燃料反应的方程式:液态氧+液态氢:。