反应 X(气)+ Y(气) 2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
| A.加催化剂 | B.降低温度 | C.增大压强 | D.增大Y的浓度 |
一定条件下,将等体积NO和O2充入一试管,并将试管倒立于水槽中,充分反应后剩余气体的体积约为原总体积的
| A.1/8 | B.1/4 | C.3/8 | D.3/4 |
下列递变规律正确的是
| A.HClO4、H2SO4、H3PO4的酸性依次增强 | B.HCl、HBr 、HI的稳定性依次增强 |
| C.钠、镁、铝的金属性依次减弱 | D.N、O、F原子半径逐渐增大 |
如图所示是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是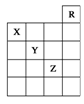
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐。②Y、Z的气态氢化物的水溶液的酸性:Y<Z。③Z的单质在常温下是液体,可与铁粉反应。④Z的原子序数比Y的大19。⑤Z所在的周期中含有32种元素
| A.①②③④ | B.①②③④⑤ | C.只有③ | D.只有①③⑤ |
下列表示物质结构的化学用语或模型正确的是
| A.8个中子的碳原子的符号:14C | B.N2的电子式∶N∶∶∶N∶ |
C.Cl-离子的结构示意图: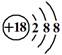 |
D.HF的电子式:H+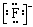 |
下列有关原子结构和元素周期律的表述正确的是
①原子序数为15的元素的最高化合价为+3②ⅦA族元素是同周期中非金属性最强的元素③第二周期ⅣA族元素的原子核电荷数和中子数一定为6④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |