(3分) 某金属X,为了确定其成分,进行一系列实验,实验过程和发生的现象如下图所示:
⑴写出金属X的化学式 。
⑵写出溶液B中溶质的化学式 。
⑶写出白色沉淀C转变为红褐色沉淀D的化学方程式 。(2分)
有机物A的分子式为C9H10O2,A在光照条件下生成一溴代物B,B分子的核磁共振氢谱中有4组峰,峰面积比为2:2:2:3,B可发生如下转化关系(无机产物略):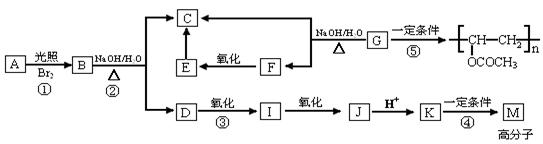
已知:①K与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构;
②当羟基与双键碳原子相连时,会发生如下转化:RCH=CHOH→RCH2CHO;
请回答下列问题:
(1)B中含氧官能团的名称是,反应①~⑤中属于取代反应的是。
(2)写出结构简式:G,E。
(3)写出下列反应的化学方程式:
反应①:,
反应③:。
(4)同时符合下列要求的K的同分异构体有种;
写出其中任意一种同分异构体的结构简式:。
Ⅰ.苯环上的一元取代物只有两种结构
Ⅱ.能发生银镜反应
Ⅲ.与氯化铁溶液发生显色反应
化合物H是一种香料,存在于金橘中,可用如下路线合成: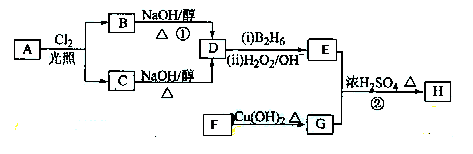
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。A的分子式是
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3-苯基-1-丙醇。F的结构简式是_
(4)反应①的反应类型是;
(5)反应②的化学方程式为
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:
。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子序数由大到小的顺序是(写元素符号)。
(2)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: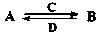 (在水溶液中进行)
(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的化学式;D的电子式。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因;A、B浓度均为0.1mol·L-1的混合溶液中,离子浓度由大到小的顺序是;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有。
二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。它的熔点-80℃,沸点138℃。常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊。
(1)写出S2Cl2的电子式__________________,该分子中Cl—S的键长______S—S的键长(填“>”,“<”或“=”)。
(2)S2Cl2遇水反应产生气体,该气体分子的空间构型为,中心原子的杂化轨道类型为。
(3)HF、H2S、HCl的稳定性由大到小的顺序为,沸点由高到低的顺序为。
(4)写出二氯化硫与水反应的化学方程式。
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为__________________,Y的价电子排布式为__________________。
(2)化合物甲由Z、U两元素组成,其晶胞如图所示。
①甲的化学式为____________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离最近的U+ 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是_____________ m3(只要求列出计算式,阿伏加德罗常数的值用NA表示)。