如图是收集某气体的装置。由实验装置推测该气体的有关性质可能正确的是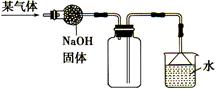
| 选项 |
A |
B |
C |
D |
| 密度比空气 |
大 |
大 |
小 |
小 |
| 溶于水中所得溶液的pH |
>7 |
<7 |
>7 |
<7 |
| 在水中的溶解性 |
大 |
小 |
大 |
小 |
按化学反应的基本类型进行分类,下列反应中不属于四个基本类型(分解反应、化合反应、置换反应或复分解反应)的是:
A.H2 + Cl2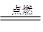 2 HCl 2 HCl |
B.2KClO3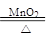 2KCl + 3O2↑ 2KCl + 3O2↑ |
C.Fe2O3 + 3CO 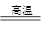 2Fe + 3CO2 2Fe + 3CO2 |
| D.CaCO3 + 2HCl ="==" CaCl2 + H2O + CO2↑ |
关于铁丝在氧气中燃烧、铁丝生锈的说法正确的是
| A.铁丝燃烧产生白烟 | B.铁丝生锈是缓慢氧化 |
| C.铁丝燃烧的产物是Fe2O3 | D.铁锈的主要成分是Fe3O4 |
在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理不正确的是
| A.在点燃易燃气体前,必须检验气体的纯度 |
| B.在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 |
| C.金属钠着火,立即用水扑灭 |
| D.皮肤上不慎沾有苯酚溶液,立即用酒精冲洗,再用水冲洗 |
下列各组离子在pH=1的溶液中能够大量共存的是
| A.OH-、K十、HCO3- | B.Ba2+、SO42-、NO3- |
| C.Na+、C1-、NH4+ | D.OH-、K十、SO3- |