A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。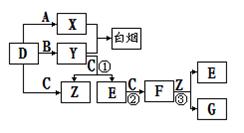
请回答下列问题:
⑴D的化学式为 。
⑵反应③的离子方程式为 。
⑶Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
⑷0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等体积混合,溶液呈________性(填“酸”、“碱”或“中”),原因是_______________________________________(用离子方程式说明)。
⑸常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
元素周期表前7周期的元素如表所示:
| 周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第6,7周期比第4,5周期多了14种元素,原因是。
(2)周期表中族所含元素最多,族元素形成化合物最多。
(3)请分析周期数与元素数的关系,然后预言第8周期最多可能含元素种数为()。
A.18B.32C.50D.64
(4)居里夫人发现镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是()。
A.在化合物中呈+2价B.氢氧化物呈两性
C.单质使水分解,放出氧气D.碳酸盐难溶于水
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
| 甲 |
乙 |
丙 |
丁 |
|
| 化合物中各元素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多两个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)试推断出各元素的符号:A;B;C;D;E。
(2)E元素位于周期表中第周期族,其最简单离子的结构示意图为,E的最高化合价为_____价。
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是____(元素符号),并写出反应的离子方程式:_________________、_________________。
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有()。
| A.1对 | B.2对 | C.3对 | D.4对 |
下图是我们熟悉的元素周期表,请回答下列问题:
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)在上面元素周期表中全部是金属元素的区域为(填序号)。
| A.A | B.B | C.C | D.D |
(3)①写出表示含有8个质子、10个中子的原子的化学符号:。
②周期表中位于第8纵行的铁元素属于第族。
③周期表中最活泼的非金属元素位于第纵行。
④所含元素超过18种的周期是第、周期。
(4)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的族。
下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 第2周期 |
⑥ |
⑦ |
||||||
| 第3周期 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 第4周期 |
② |
④ |
⑨ |
(1)10种元素中,化学性质最不活泼的是________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____。
(4)元素⑦的氢化物的化学式为________;该氢化物常温下和元素⑧的单质反应的化学方程式为______________________。
(5)①和⑨两种元素形成化合物的化学式为______,该化合物燃烧时的焰色为______,该化合物溶液与元素⑧的单质反应的化学方程式为________________。