甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
⑵在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
现有①硫酸铜②碳酸钙固体③磷酸④硫化氢⑤三氧化硫⑥金属镁⑦石墨⑧苛性钾⑨NH3·H2O⑩熟石灰,其中(填序号)属于强电解质的是,属于弱电解质的是,属于非电解质的是,既不是电解质,又不是非电解质的是。
(1)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。
①晶体中每个Cl-同时吸引着_______个Na+。
②晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个。
③每个晶胞中有个NaCl。
(2)下面是s能级p能级的原子轨道图,试回答问题:
s电子的原子轨道呈形;p电子的原子轨道呈形,每个p能级有个原子轨道。
下表是元素周期表的一部分,回答有关问题
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
a |
b |
||||||
| 3 |
c |
d |
e |
f |
g |
h |
i |
|
| 4 |
j |
k |
l |
(1) 画出下列元素的轨道表示式:
a:d:
(2)写出下列元素原子的电子排布式:
k:l:
(3) 在这些元素中,第一电离能最小的元素是_____,电负性最大的元素是_____,最不活泼的元素是______;(填元素符号或化学式,下同)
(4) 在这些元素的最高价氧化物对应的水化物中,酸性最强的是_____,碱性最强的是_____,呈两性的氢氧化物是_____
(5) 在g与h元素中,非金属性较强的是_____,用一个化学方程式验证该结论:
(6)元素d和e的电离能如下:
| 电离能kJ/mol |
I1 |
I2 |
I3 |
I4 |
| d |
738 |
1450 |
7730 |
10550 |
| e |
577 |
1817 |
2745 |
11578 |
请解释元素d的I1比元素e的I1大的原因
(7分)科学家们发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的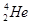 、
、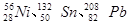 等尤为稳定。根据此信息回答下列问题:(每空1分)
等尤为稳定。根据此信息回答下列问题:(每空1分)
⑴写出前三种幻数为质子数时的元素原子结构示意图,并标明元素符号:;;。
⑵已知氧有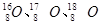 三种同位素,根据上述幻数规律,氧的同位素中原子核最稳定的是;
三种同位素,根据上述幻数规律,氧的同位素中原子核最稳定的是;
⑶根据现有元素周期律推算,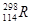 位于元素周期表的第周期族,核稳定性
位于元素周期表的第周期族,核稳定性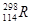
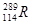 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(12分)有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B 元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有12个中子的二价金属,当2 .4克C与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子。(①②③每空1分)
①写出A~D元素符号:A____,B_____,C_____,D_____
②写出A的原子结构示意图:B的离子结构示意图::
D在周期表的位置:C和D所形成的化合物的电子式
③分别写出B 、D的最高价氧化物的水化物的化学式______ ,______
④比较D的气态氢化物与H2S和HF的稳定性:(2分)