写出铜与稀硝酸反应的化学方程式,用单线桥标出电子转移情况
该反应的氧化剂 ,还原剂 ,氧化剂和还原剂物质的量之比为 。
【化学-有机化学基础】菠萝酯(结构简式如下)是一种具有菠萝香气的食用香料,
其的合成路线如下: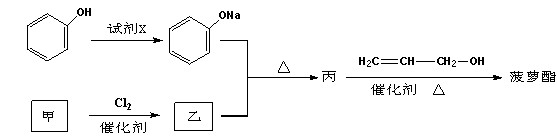
提示:
(1)有机物乙中所含有的官能团是_________
(2)上述合成菠萝酯的过程中,下列反应类型中未涉及到的是___________。
| A.取代反应 | B.加成反应 | C.消去反应 | D.中和反应 |
(3)菠萝酯有多种同分异构体,写出同时满足下列三个条件的同分异构体的结构简式。(写出其中的一种即可)
①能使溴的四氯化碳溶液褪色,遇FeCl3溶液不显紫色
②除苯环外无其他环状基团
③能与NaOH溶液反应,且1mol该同分异构体最多能与2molNaOH反应
_____________________________________________________________________
(4)写出由丙→菠萝酯的化学化学方程式。______________________________________。
【化学-物质结构与性质】
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为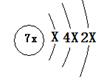 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)写出下列元素的符号:B 、C 。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是 ,电负性最大的元素是 。
(3)已知元素周期表可按电子排布分为s区、q区等,则E元素在 区。
(4)画出A的核外电子排布式 。
【化学-化学与技术】
海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但常规蒸馏法法也存在较大缺陷,请说明常规蒸馏法淡化海水的最大缺陷。
__________________________________________________________
(2)离子交换法也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式。
(3)目前从海水中提取溴的常用流程如下(苦卤,海水蒸发结晶分离出食盐的母液):
从反应③后的溶液中分离出单质溴的方法是。
(4)海水提镁过程中,与石灰窑和盐酸厂有着紧密的联系,试说明海水提镁与盐酸厂之间的必然联系。__________________________________________________________
(本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置,
(2)写出检验D溶液中阳离子的方法。
(3)写出反应④的离子方程式。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH7
(填“>”、“<”或“=”),用离子方程式表示其原因:;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是。
(本题共12分)
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据物质之间的转化关系回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为;
(2)写出电解A溶液的化学方程式为;
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有(填字母代号);
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离
(4)将F和J通入A的饱合溶液中的顺序为。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中
NaCl的质量分数。

样品mg溶液沉淀固体ng
①检验沉淀是否洗涤干净的所用到的试剂是:,
②样品中NaCl的质量分数的数学表达式为:。