中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
| A.用一定量NaOH稀溶液和稀盐酸反应测得的中和热数据,来推算一定量稀H2SO4和NaOH稀溶液反应的反应热 |
| B.用沸点数据推测能否用蒸馏的方法将两种液体混合物进行分离 |
| C.用反应热数据的大小判断不同反应的反应速率大小 |
| D.用原子(或离子)半径数据推断同周期或同主族某些原子(或离子)氧化性或还原性的强弱 |
下列过程一定有化学变化的是:
| A.盐溶于水 | B.酒精挥发 | C.水结成冰 | D.铁器生锈 |
被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O===ZnO+2MnO(OH)下列说法正确的是
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023 |
| D.电池正极反应式为MnO2+e-+H2O===MnO(OH)+OH- |
a毫升A、B、C三种气态烃任意比的混合物跟足量氧气混合点燃后, 恢复到原常温常压状态, 气体体积共缩小了2.5a毫升, 那么A、B、C三种烃可能是
A.CH4、C2H6、C3H8B.C2H4、C2H6、CH4
C.CH4、C2H2、C2H6D.C2H6、C3H6、C4H6
科学家在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
| A.X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色 |
| B.X是一种常温下能稳定存在的液态烃 |
| C.X和乙烷类似,都容易发生取代反应 |
| D.充分燃烧等质量的X和甲烷,X消耗氧气较多 |
六苯乙烷为白色固体,其结构表示如图:下列有关说法中正确的是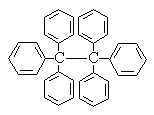
| A.它是一种苯的同系物,易溶于有机溶剂中 |
| B.它的分子式为C38H30,只含有非极性键 |
| C.它的一氯代物只有三种 |
| D.在同一平面上的原子最多有14个 |