有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
| 第一组 |
He -268. 8 8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
| 第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
| 第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
| 第四组 |
H2O 100.0 |
H 2S -60.2 2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
下列各项中正确的是
| A.a、b、c的化学式分别为Ne2、Br2、HF |
| B.第二组物质只表现氧化性,不表现还原性 |
| C.第三组物质中C的沸点最高,是因为C分子的式量最大 |
| D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te |
下列描述中正确的是 ( )
| A.CS2分子的立体构型为V形 |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有每个原子均满足最外层8电子稳定结构 |
D.SiF4和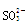 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
下列分子或离子不能跟质子结合的是( )
A.NH3 B.H2O C.OH- D.NH4+
下列物质的分子中,键角最小的是( )
| A.H2O | B.BF3 | C.NH3 | D.CH4 |
下列是几种原子的基态电子排布,电负性最大的原子是( )
| A.1s22s22p4 | B.1s22s22p63s23p3 |
C.1s22s22p63s23p2 | D.1s22s22p63s23p64s2 |
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
| A.1s22s22p63s23p2→1s22s22p63s23p1 | |
| B.1s22s22p63s23p3→1s22s22p63s23p2 | |
| C.1s22s22p63s23p4→1s22s22p63s23p3 | D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1 |