下图是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过。下列说法正确的是
| A.B电极反应式:2Cl- - 2e → Cl2↑ |
| B.W是稀的氯化钠溶液 |
| C.Z是氢氧化钠溶液 |
| D.a是电源负极 |
下列根据实验操作和现象所得出的结论正确的是:
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 |
试纸不变蓝 |
原溶液中无NH4+ |
| B |
向NaAlO2溶液中滴入NaHCO3 |
有白色沉淀 |
AlO结合H+能力比CO强 |
| C |
向溶液中滴加盐酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中一定含有SO |
| D |
工业上,将BaSO4浸泡在饱和Na2CO3溶液中 |
将BaSO4转化为BaCO3 |
Ksp(BaSO4)>Ksp(BaCO3) |
甲酸香叶酯是一种食品香料.可以由香叶醇与甲酸发生酯化反应制得。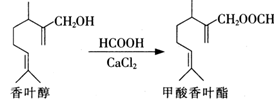
下列说法中正确的是
| A.香叶醇分子中含有1个手性碳原子 |
| B.香叶醇可发生消去、加成、氧化反应 |
| C.1 mol甲酸香叶酯可以与1molNaOH反应 |
| D.甲酸香叶酯分子中所有碳原子均可能共平面 |
下列有关说法正确的是
| A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H<0 |
| B.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
C.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 |
短周期元素X、Y、Z、W的原子序数依次增大,X是组成水的元素之一,Y原子最外层电子数是次外层的3倍;Z是地壳中含量最多的金属元素,W的原子序数是Y的2倍。下列叙述正确的是
| A.原子半径的大小顺序:Y>Z>W>X |
| B.元素Y的简单气态氢化物的热稳定性比W的弱 |
| C.由Y、Z、W四种元素组成的化合物其水溶液一定显中性 |
| D.Z元素最高价氧化物对应水化物既溶解于盐酸也溶解于氢氧化钠 |
右图是某同学设计的原电池装置,下列叙述中正确的是
| A.电极Ⅰ上发生氧化反应,作原电池的正极 |
| B.反应一段时间后,电极Ⅱ的电极质量增大 |
| C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |