三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业。下图是我国科技工作者于2004年研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”:
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水;
③以尿素为原料生产三聚氰胺的原理是:
6CO(NH2)2 C3N6H6 + 6NH3 + 3CO2
C3N6H6 + 6NH3 + 3CO2
请回答:
(1)尿素是一种常用含氮量最高的化肥,其氮元素的质量百分数为 ,在实验室使其熔化的容器名称叫_________ 。工业上合成尿素的化学反应方程式为___________________________________(反应条件可以不写)
(2)写出各主要成份的化学式:产品1 、产品2 、X ;
(3)联氨系统沉淀池中发生的化学反应方程式为: ;
(4)若生产过程中有4%的尿素损耗,每吨尿素可生产三聚氰胺 吨,副产品纯碱 吨。
根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa ⑥CH3COOH⑦ NH3•H2O⑧H2O
请回答下列问题:
(1)NH4Cl溶液显性,用离子方程式表示,其溶液中离子浓度大小顺序为;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是。
| A.向水中加入NaHSO4固体 | B.向水中加Na2CO3固体 |
| C.加热至100℃[其中c(H+) = 1×10-6 mol•L-1] | D.向水中加入 (NH4)2SO4固体 |
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 mn (填“<”、“>”或“=”)。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:____________________________________________________。
(14分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s)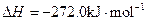
2Al(s)+3/2O2(g)= Al2O3(s)
Al和FeO发生铝热反应的热化学方程式是________________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_____(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率___ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(14分)有机物A1和A2含有碳、氢、氧三种元素且互为同分异构体。已知6 g A1在足量的氧气中完全燃烧生成13.2 g二氧化碳和7.2 g水。有关物质之间的转化关系如下: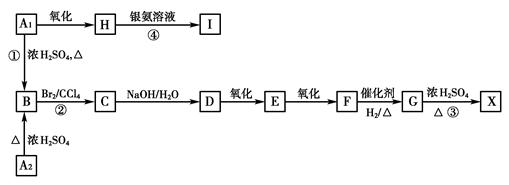
已知:X为六元环状化合物,完成下列问题:
(1)A1的分子式为_____________,X的结构简式:________________。
(2)E中含氧官能团的名称:。
(3)反应④的化学方程式:;
C到D 的化学方程式:;
反应②属于__________ 反应。
(4)与G具有相同官能团的G的同分异构体M在酸性条件下,加热失水生成N,N的甲酯可以发生加聚反应生成聚合物P,聚合物P的结构为:。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 ________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式) 。
。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到。用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
( 12 分)(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
。
②溶液a中存在的阴离子有__________________;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________;为此,改进方法是。
(2)该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是(填代号)
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |