五种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.104 |
0.111 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.R与M的单质及其化合物有相似的化学性质
B.L、M的单质均用电解其熔融的盐的方法冶炼而得
C.T的氢化物还原性及稳定性均比Q的氢化物强
D.五种元素的常见简单离子中半径最大的是Q2-
下列说法正确的是
| A.糖类物质的分子都可以用Cm(H2O)n来表示 |
| B.凡能溶于水具有甜味的物质都属于糖类 |
| C.糖类都能发生水解反应 |
| D.糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物 |
下列装置或操作能达到实验目的的是
| A.图1所示装置可检查装置气密性 |
| B.图2所示装置可从碘的CCl4溶液中分离出碘 |
| C.图3所示装置可除去甲烷中乙烯 |
| D.图4所示装置可分离甲苯与乙醇 |
由2-氯丙烷制取少量的1,2-丙二醇时,需要经过的各反应分别为
| A.加成反应,消去反应,取代反应 | B.消去反应,加成反应,取代反应 |
| C.取代反应,消去反应,加成反应 | D.取代反应,加成反应,消去反应 |
下列物质既能发生消去反应,又能发生水解反应的是
| A.一氯甲烷 | B.2-甲基-1-溴丙烷 |
| C.2,2-二甲基-1-氯丙烷 | D.2,2,4,4-四甲基-3-氯戊烷 |
下列有关化学用语表示正确的是
| A.乙醇的结构简式C2H6O |
B.氨基的电子式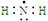 |
C.镁离子的结构示意图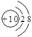 |
D.中子数为79、质子数为55 的铯(Cs)原子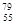 Cs Cs |