CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl 2·6H2O的一种新工艺流程如下图:
2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl→CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为____________________________________________________。
(2)加入碳酸钠调节pH至a,a的范围是_______________________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是___________________________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________________________。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是___________________________。
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行_______________操作。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液的实验如下:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| (4)取(3)中的上层清夜,加AgNO3 |
有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 |
有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
①.溶液中一定存在的离子是;溶液中肯定不存在的离子是:
②.为进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细步骤)
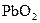 是很强的氧化剂,在酸性溶液中它可将
是很强的氧化剂,在酸性溶液中它可将 氧化成
氧化成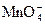 。取1支试管,加入少量
。取1支试管,加入少量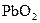 固体和2mL6 mol
固体和2mL6 mol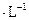
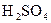 ,然后滴入2mL1 mol
,然后滴入2mL1 mol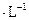
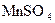 溶液。试回答:
溶液。试回答:
(1)搅拌后,溶液的颜色变化是_____________________________
(2)反应的化学方程式是___________,硫酸的作用是________________
(3)能否用盐酸代替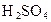 ________(填“能”或“不能”),用化学方程式回答
________(填“能”或“不能”),用化学方程式回答
_______________
两种非金属元素x、Y在元素周期表中彼此相隔一个周期,它们的单质Xm、Yn和水在一定条件下能发生反应:Xm+Yn+H2O→HY+H3XO4+XH4Y(未配平)。(m、n均为大于l的正整数)
(1)若xmYn在常温下均为常见固体,则Xm是__________,Yn是__________;(填化学式)
(2)试根据推断后,完成(配平)上述化学方程式_____________________
(3)试解释下列两反应能进行的原因: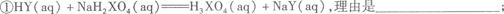
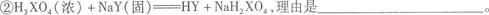
X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X → A(g), Y+Z → B(g)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
① Y的化学式是;
②生成固体C的化学方程式是。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
① B的化学式是;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
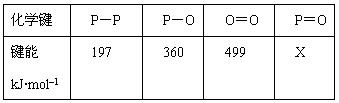
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=kJ·mol–1。