下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项编号对应的曲线编号错误的是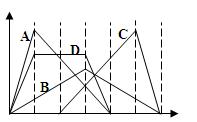
| A.向NaAlO2溶液中逐渐滴入HCl至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 |
下列说法不正确的是:
| A.乙醇和浓硫酸反应制乙烯时,利用NaOH溶液可除去杂质气体 |
| B.向饱和Na2CO3溶液中通入足量CO2,可析出NaHCO3,使溶液变浑浊。 |
| C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 |
| D.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
镁锰干电池的电化学反应式为:Mg+2MnO2+H2O  Mg(OH)2+Mn2O3。下列说法不正确的是:
Mg(OH)2+Mn2O3。下列说法不正确的是:
| A.镁为负极,发生氧化反应 |
| B.可以选择碱性溶液作为电解质 |
| C.反应后正极和负极附近溶液的pH均升高 |
D.正极的电极反应为:2MnO2+H2O+2e- Mn2O3+2OH- Mn2O3+2OH- |
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程:
下列说法正确的是:
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+ 1/2 O2(g)  CO2(g)∆H=-283.0 kJ/mol
CO2(g)∆H=-283.0 kJ/mol
S(g)+ O2(g) SO2(g)∆H=-296.0 kJ/mol
SO2(g)∆H=-296.0 kJ/mol
下列说法不正确的是:
| A.两个反应均为氧化还原反应 |
| B.CO2与SO2可以用澄清石灰水鉴别 |
| C.CO2分子中各原子最外层均为8电子稳定结构 |
D.相同条件下:2CO(g)+SO2(g)  S(g)+2CO2 (g)∆H=-270kJ/mol S(g)+2CO2 (g)∆H=-270kJ/mol |
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |