下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题: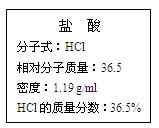
(1)该浓盐酸中HCl的物质的量浓度为 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________(填编号)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl—的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.40 mol/L的稀盐酸。
①该学生需要量取 mL(精确到小数点后一位)上述浓盐酸进行配制。
②现有a.10 mL量筒;b. 25 mL量筒;c.烧杯;d.托盘天平;e. 500 mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序: (填编号)。
③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填 “偏高”、“偏低”或“无影响”):
定容时俯视观察_________;
定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水__________。
(1)有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平)。
②该反应中氧化剂与还原剂的物质的量之比为。
③产生2mol还原产物时转移电子的总数为。
(2)实验室配制0.5mol/L的NaCl溶液500mL,有以下仪器;
①烧杯②100mL量筒③1000 mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有(填序号),还缺少的仪器是实验两次用到玻璃棒,其作用分别是、。
mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有(填序号),还缺少的仪器是实验两次用到玻璃棒,其作用分别是、。
(3)有一瓶澄清的溶液,可有含有大量的NO-3、Fe3+、NH+4、H+、K+、Mg2+、Al3+、SO2-4、Ba2+、CO2-3、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤ 将实验③中的碱性溶液加热,有气体放出,该气体
将实验③中的碱性溶液加热,有气体放出,该气体 能使湿润的红色石蕊试纸变蓝。
能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有。
溶液中不能确定是否存在的离子有。
.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
正确的操作步骤是_________________________________
某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是_________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是___________;(填序号)记录C的液面位置时,除视线平视外,还应_______________。
(4)B中发生反应的化学方程式为____________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“不受影响”)。
有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、NaHSO4、
BaCl2中的一种,为了确定各是何种溶液进行了下列实验,记录为:
①A + D → 溶液+ 气体,
②B + C → 溶液+ 沉淀,
③B + A → 溶液+ 沉淀X,
④D + B → 溶液Y + 沉淀,
⑤溶液Y + 沉淀X → 溶液+ 气体。
(1)根据以上记录确定:A_________B__________C__________D________(填化学式)
(2)写出①、③、⑤各反应的离子方程式:
①______________________________
③______________________________
⑤_______________________________
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶、烧杯外还需要的其它玻璃仪器 |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)。
| A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2—3 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是。
(4)若出现如下情况,对所配溶液浓度将有何影响?
没有进行A操作;
加蒸馏水时不慎超过了刻度;
定容时俯视_________________________。