对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是( )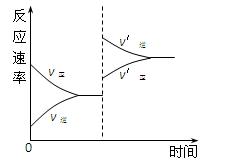
| A.X、Y均为气体,Z、W中有一种为气体 |
| B.Z、W中有一种是气体,X、Y皆非气体 |
| C.X、Y、Z、W皆非气体 |
| D.Z、W均为气体,X、Y中有一种是气体 |
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性. |
| Z |
元素最高正价是+7价 |
(1)元素T为元素(填元素名称)。元素X的一种核素可测定文物年代,这种核素的符号是。
(2)元素Y在周期表中的位置。
(3)元素Z的原子结构示意图为。
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),能证明这一事实的依据是。
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是(填酸的化学式),理由是。
(6分)将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。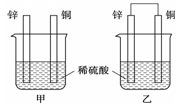
(1)以下叙述中,正确的是(填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
(2)装置乙中,总反应的离子方程式为;若导线上通过0.2 mol电子,消耗锌的质量为g。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0
CH3OH(g)+H2O(g) △H=-49.0  kJ·mol-1
kJ·mol-1
某科学实验将6molCO2和8molH2充入体积为2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。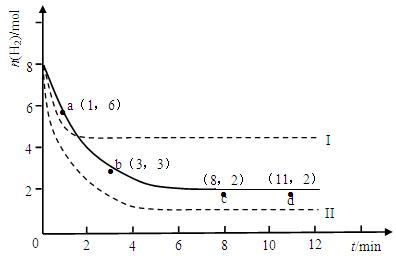
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是__________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
(3)如果体积可变,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是__________,曲线II(更快平衡)对应的实验条件改变是___________。
(4)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)==CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2 )·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________
)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________
.某反应2A B+C,在某一温度时,达到平衡。
B+C,在某一温度时,达到平衡。
①.若B是固体,降低压强时,平衡向左移动,则A是___________态。
②.若A、B都是气态,加压 时,平衡不移动,则C为态。若同时该反应为热(填吸或放),则该反应为自发反应。
时,平衡不移动,则C为态。若同时该反应为热(填吸或放),则该反应为自发反应。